Substâncias e misturas
Substâncias e misturas são os formatos nos quais encontramos os diferentes reagentes químico. Além disso: você é formado por eles, assim como tudo ao seu redor.
Substâncias e misturas são os formatos nos quais encontramos os diferentes reagentes químico. Além disso: você é formado por eles, assim como tudo ao seu redor.
Desde Demócrito, na Grécia antiga, já se sabia que tudo era formado por partículas cada vez menores. Passando pelos modelos atômicos de Dalton, Thomson e Rutherford-Bohr, o conceito de átomo foi sendo aprimorado, sem perder, contudo, a sua essência: a de partícula formadora da matéria. Claro, atualmente sabe-se que há muitas outras partículas além de prótons e elétrons, mas para nosso estudo, vamos ficar por aqui mesmo.
Um átomo é composto de prótons (partículas de carga positiva), nêutrons (partículas de carga nula) e elétrons. Suponha um átomo com 14 prótons e 14 nêutrons no núcleo, rodeado por 14 elétrons. Seria apenas um átomo certo? Agora imagine vários desses átomos juntos: teremos um elemento químico! Resumindo, átomos com o mesmo número de prótons são átomos do mesmo elemento químico.
Agora que sabemos o que é um elemento químico, podemos falar de matéria. Afinal, o que é matéria? O ar é matéria? Sim. Toda matéria é formada por átomos, que formam elementos químicos. Genericamente, diz-se que tudo que ocupa lugar no espaço é matéria - inclusive o ar. A prova disso? Pese e compare u balão cheio e um balão vazio.
Após esses conceitos iniciais, podemos falar de substâncias, que nada mais é do que uma parte da matéria com propriedades definidas, conferindo-lhe uma característica única.
Propriedades das substâncias:
- Mudança de estado físico
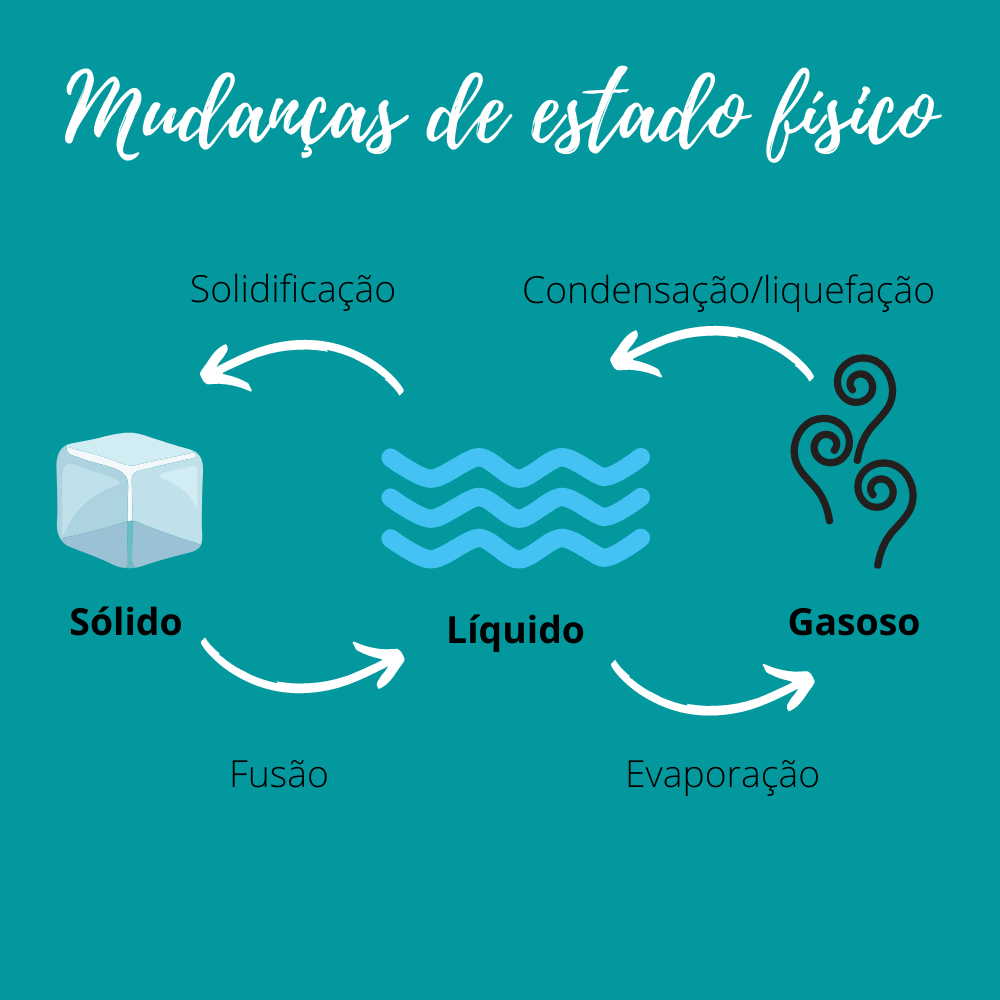
Pode ser que não percebamos, mas há mudanças de estado físico ocorrendo neste exato momento. Os principais estados da matéria são o sólido, o líquido e o gasoso (há outros estamos, mas, para nosso estudo, estes três estão ótimos). Assim, temos 6 reações de mudança de estado:
- Fusão: sólido-líquido
- Vaporização: líquido-gás/vapor
- Condensação ou liquefação: gás/vapor-líquido
- Solidificação: líquido-sólido
- Sublimação: líquido-gás/vapor
Essas mudanças ocorrem com o princípio de absorção e liberação de energia.
Saiba mais: estados da matéria
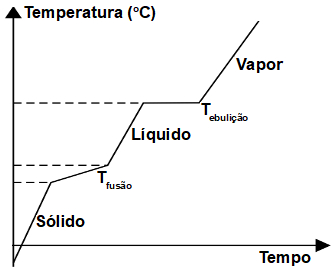
- Curva de aquecimento
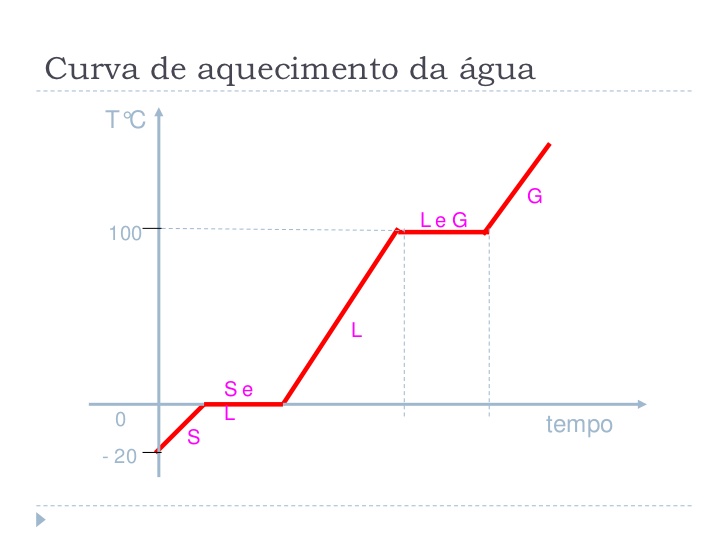
A curva de aquecimento
de uma substância é um gráfico que relaciona o "caminho" de uma substância desde
o estado sólido até o estado gasoso/de vapor com o tempo que essa reação demora
para acontecer.
- Curva de resfriamento
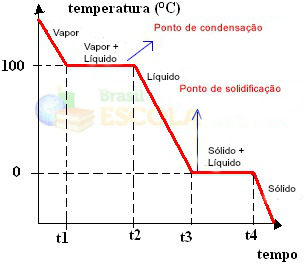
- Ponto de fusão
O ponto de fusão é a temperatura na qual a substância passa do estado sólido para o estado líquido, ou seja, sofre uma fusão.
- Ponto de ebulição
O ponto de ebulição é a temperatura na qual uma substância sofre ebulição, ou seja, passa do estado líquido para o gasoso.
- Densidade
A densidade pode ser definida de uma forma simples: quanta massa cabe em determinado volume? Assim, vamos supor que uma caixa com um volume de 1 cm^3, cheia de mercúrio, seja pesada em uma balança e o resultado seja 13,6 g. Isso quer dizer que, para cada centímetro cúbico de mercúrio, teremos uma massa de 13,6 g.
Vamos supor outra situação: qual deve ser o volume de uma caixa para que esta consiga guardar 27,2 g de mercúrio?
Pois bem, se:
13,6 g -------------- 1 cm^3
27,2 g -------------- x cm^3
x = 2 cm^3
Matematicamente, essa relação é expressa por:
d = m/v
Em que d corresponde à densidade, m corresponde à massa e v ao volume. Essa grandeza pode ser expressa de várias maneiras: g/L, g/cm^3, kg/L, g/m^3, etc. Preste muita atenção nas unidades.
Atente-se: a densidade pode ser traiçoeira: o que pesa mais, 1 kg de água ou 1 kg de chumbo? Os dois pesam um kg, mas o chumbo ocupa mais espaço do que a água.
A densidade depende, além do material do qual o objeto é feito, da temperatura, pois causa uma dilatação no material, alterando o volume.
Para saber se um material "boia" ou não em outro, basta ver a densidade. Por exemplo, a cortiça (0,32 g/cm^3) tem uma densidade menor que a da água (1,0 g/cm^3), que por sua vez tem uma densidade menor que a do chumbo (11,3 g/cm^3), afundado.
- Classificação das substâncias
- Substância pura
Para ser pura, uma substância precisa estar isolada de outras substâncias. Vamos tomar por exemplo o sal de cozinha, diluído em água. Com base no conceito de substância já apresentado, é possível notar que isso não é uma substância pura, pois além da água, há o sal.
- Mistura
A mistura se caracteriza por ser o resultado da adição de duas substâncias puras. Uma vez adicionadas, passamos a chama-las de componentes da mistura. O sal de cozinha diluído em água é um exemplo, pois é resultado da mistura do cloreto de sódio (NaCl) com a água.
- Mistura homogênea
Dentro das misturas, temos aquelas que são homogêneas, ou seja, possui as mesmas propriedades em toda a sua extensão. Em outras palavras, possui uma fase.
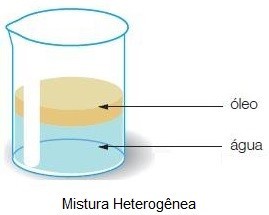
- Mistura heterogênea
É aquela mistura que possui mais de uma fase. Uma mistura de água e óleo, por exemplo, apresenta dos "níveis": o da água e o do óleo. Cada "nível" corresponde a uma fase.
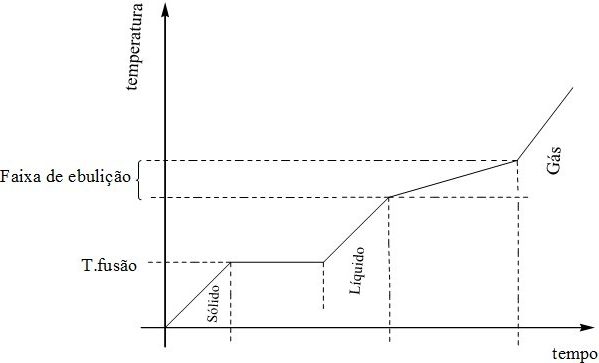
- Mistura azeotrópica
Uma mistura azeotrópica é aquela que possui apenas um ponto de ebulição, enquanto a fusão se ocorre em um intervalo de tempo. É comum em líquidos.
- Mistura eutética
Uma mistura eutética é aquela que possui um apenas um ponto de fusão, mas a ebulição ocorre durante um intervalo de tempo. É muito comum em ligas metálicas.
- Sistema
É a amostra da matéria com a qual trabalhamos, por exemplo, um béquer com água e cloreto de sódio.
Misturas puras podem ser tanto homogêneas como heterogêneas. Quando encontradas em um único estado físico, são homogêneas. Quando encontradas em mais de um estado líquido, são heterogêneas (água e gelo, por exemplo).
ATENTE-SE: Toda substância pura é uma mistura homogênea, mas nem toda mistura homogênea é uma substância pura!
- Métodos de separação de mistura:
- Misturas sólido/sólido
- Catação: separação manual dos componentes da mistura.Exemplo: separação seletiva do lixo.
- Flotação: quando se possui dois sólidos, pode-se adicionar um líquido com densidade intermediária à densidade dos mesmos. Assim, o sólido mais denso fica na primeira fase, o líquido fica na segunda fase e o sólido menos denso fica na terceira fase. Exemplo: mistura de areia com serragem,
- Separação magnética: consiste em utilizar um ímã para atrair o componente com propriedades magnéticas. Exemplo: limalha de ferro na areia.
- Ventilação: é o uso de uma corrente de ar para separar os sólidos. Exemplo: beneficiamento do café (processo no qual a casca separa-se da semente).
- Levigação: é o uso de água para separar os sólidos. Exemplo: garimpo, para separar o ouro das impurezas.
- Dissolução fracionada: um dos componentes sólidos é diluído quando um líquido (solvente) é adicionado. Exemplo: água com sal e areia.
- Misturas sólido/líquido
- Filtração: utiliza uma barreira física (filtro) para separar o líquido do sólido. Exemplo: uma mistura de areia e água.
- Decantação: o sistema permanece em repouso e as partículas sólidas se depositam no fundo do recipiente. Exemplo: água com barro.
- Centrifugação: consiste em colocar uma amostra em uma centrífuga para acelerar o processo de decantação. Exemplo: sangue (separação do plasma)
- Destilação simples: consiste no aquecimento do sistema até certo componente atingir seu ponto de ebulição e evaporar, para depois passar por um condensador para ser resfriado. O sólido permanece no recipiente original e o líquido é coletado à parte. Exemplo: água com sal de cozinha (separação do NaCl da água)
- Misturas sólido/gás
- Filtração: utiliza uma barreira física (filtro) para separar o líquido do sólido. Exemplo: aspirador de pó
- Mistura líquido/líquido
- Decantação: para esse processo, é usado um funil de decantação, permitindo a separação dos líquidos conforme sua densidade, do mais denso para o menos denso. Exemplo: água e óleo.
- Destilação fracionada: consiste em aquecer a mistura até o ponto de ebulição de um de seus componentes (geralmente o de interesse), fazendo com que ele passe por um condensador e se torne líquido novamente. Esse processo é usado para separar misturas de líquidos que apresentem mais de três componentes. Exemplo: extração do petróleo.
- Mistura gás/gás
- Liquefação fracionada: processo similar à destilação. A temperatura é diminuída até que um dos gases dos compostos passem para o estado líquido. Exemplo: separação dos componentes do ar.
Texto por Giovana Bagnara Luisi
Estudante de Química
Referências:
(TITO), Francisco Miragaia Peruzzo; CANTO, Eduardo Leite do. Química: na abordagem do cotidiano. 3. ed. São Paulo: Moderna, 2007. 760 p.
SCARPELLINI, Carminella; ANDREATTA, Vinícius Barbosa. Manual compacto de Química: Ensino Médio. São Paulo: Editora Rideel, 2011. 448 p.