pH: conceitos iniciais
Logaritmo:
Definição
Matematicamente, um logaritmo de um número b, na base a, sendo ambos diferentes de zero e diferentes entre si, é um número x, tal que x é o expoente de a para se obter b.

Nos logaritmos decimais, de base 10, a base omitida. Assim, o logaritmo de 2 na base 10 é representado por log 2. Há uma tabela na qual os valores estão catalogados.
Além de saber disso, é importante relembrar algumas propriedades dos logaritmos que são utilizadas para o cálculo de pH:
Log (a x b) = log a + log b
Log (m/n) = log m - log n
O pH será trabalhado com potência de 10, então podemos resolver os problemas de duas maneiras. Quando temos o pH como expoente na base 10, é de grande utilidade saber que, se houver um "dado: log 2 = 0,3" que esse 0,3 pode passar para a base 10, ficando 10^0,3.
As fórmulas para o cálculo de pH e pOH são:
- pH = - log [H3O]^+
- [H3O^+] = 10^-pH
- pH = M x α
- [OH^-] = 10^-pH
- [OH^-] = M x α
- p[OH^-] = - log [OH^-]
Cologaritmo:
É o oposto do logaritmo. É com ele, na verdade, que mais trabalhamos.
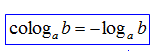
Ácidos e bases
Há várias teorias sobre os ácidos e bases.
Para Lewis, um ácido é aquele que aceita um par de elétrons e uma base é aquela que doa um par de elétrons. Para Arrhenius, o ácido são compostos que sofrem dissociação, liberando o cátion H3O^+. Já as bases se dissociam e liberam o ânion hidroxila (OH^-). Para fins didáticos, é muito comum o trabalho com a teoria de Arrhenius.
Texto por: Giovana Bagnara Luisi
Estudante de Química
Referências:
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2012. 1026 p. Tradução técnica: Ricardo Bicca Alencastro.
SCARPELLINI, Carminella;
ANDREATTA, Vinícius Barbosa. Manual compacto de Química: Ensino Médio. São Paulo: Editora Rideel, 2011. 448 p.
BOSQUILHA, Alessandra; CORRêA, Marlene Lima Pires; VIVEIRO, Tânia Cristina Neto G.. Manual compacto de matemática. São Paulo: Editora Rideel, 2010. 432 p.
