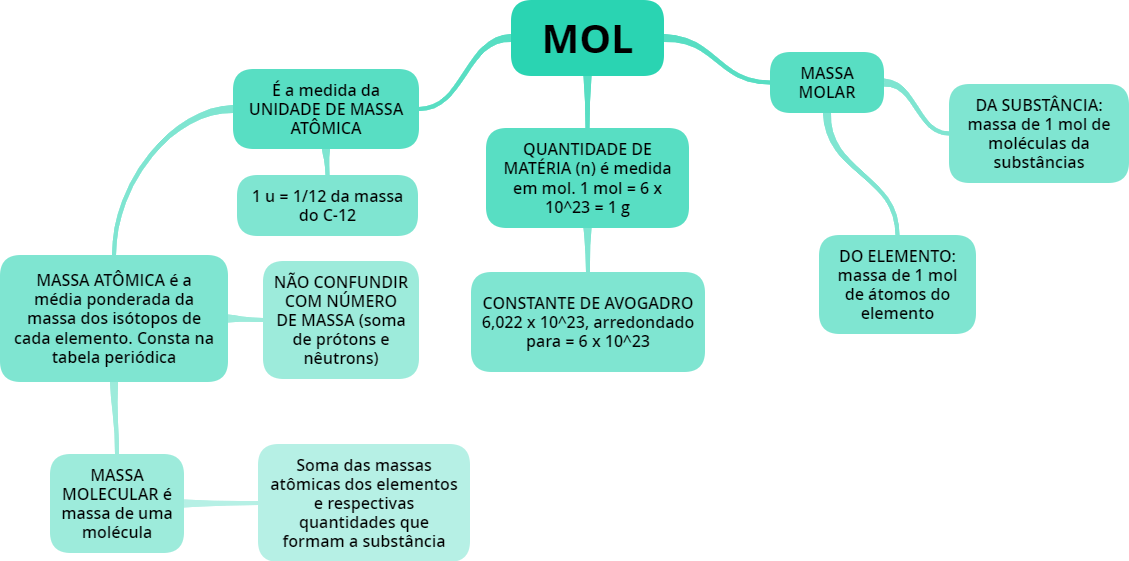
Mol
Afinal, quanto vale um mol? O que é um mol? E a unidade "u"? Vamos compreender tudo isso e muito mais (com bastante calma).
Constante de Avogadro, unidade de massa atômica, massa molar, mol... o que vem a ser tudo isso?
Unidade de massa atômica u
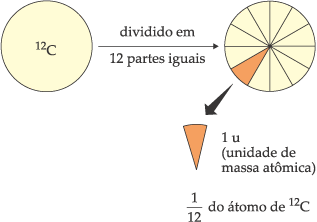
Quanto pesa um átomo, em gramas? Essa pergunta, feita dessa forma, é muito difícil de ser respondida. O grama e seus derivados não são a melhor unidade de medida para isso. Para tudo, é necessário um padrão. Inclusive para a unidade de massa atômica "u". Assim, ficou determinado que 1 unidade de massa atômica seria equivalente a 1/12 da massa do carbono-12. Pense como se toda toda a massa do carbono-12 fosse uma pizza. Essa pizza estaria dividida em 12. Você separa 1 pedaço. Ou seja, 1 unidade de massa atômica "u".
Massa atômica
Agora que já sabemos um pouco sobre a unidade de massa atômica, podemos entender o que é a massa atômica. A massa atômica é, simplesmente, a massa de um átomo. Assim, quando dizemos que o sódio tem massa atômica de 23 u, podemos interpretar que, para o sódio, sua massa será equivalente a 23 vezes 1/12 do carbono 12.
Já sabemos quanta massa possui um átomo. Mas e a massa atômica de um elemento? Essa é a massa que aparece na tabela periódica. Embora muitas vezes coincidam, número de massa e massa atômica não são a mesma coisa! Na natureza, é muito comum que os átomos passem por um processo de isotopia. Ou seja, um elemento, com o mesmo número de prótons, pode ter várias massas diferentes. O boro, por exemplo, pode ser encontrado como boro-10 ou boro-11. A diferença? Um nêutron. Assim, esses isótopos naturais existem em determinadas proporções ( no caso do boro-10 e do boro-11, 19,9% e 80,1%, respectivamente). Por isso, a massa atômica de um elemento é definida como a média ponderada da massa dos isótopos. Já o número de massa é a soma de prótons e nêutrons.
Saiba mais: massa atômica e defeito de massa
Massa molecular
Se um átomo tem determinada massa que pode ser expressa em u, uma molécula também pode ter sua massa determinada desse jeito? Com certeza. É o que chamamos de massa molecular. Por exemplo, a água, é composta por dois átomos de hidrogênio e um átomo de oxigênio. Assim, tendo em vista que a massa atômica do hidrogênio e do oxigênio são, respectivamente, 1u e 16u, temos que:
H = 1 u x 2 = 2
O = 16 u x 1 = 16
H2O = 16 + 2 = 18 u massa de 1 molécula de água.
A massa molecular também é calculada para substâncias simples. Por exemplo, quanta massa tem uma molécula de oxigênio (O2)? Se um átomo de oxigênio tem uma massa tal que O = 16 u, dois átomos de oxigênio que formam uma molécula de gás oxigênio tem uma massa de 32 u. A massa molecular do ozônio (O3), por consequência, é 48u.
Massa de um íon
E a massa de um íon? Bem, como a massa de um elétron é aproximadamente 9,1 x 10^-31 (ou seja, desprezível) ela não é considerada nos cálculos.
Quantidade de matéria
Certo, mas até agora, tudo muito abstrato, não? Vamos trazer para a nossa realidade e ver como u se relaciona com o grama. Através de muitos e muitos experimentos, foi estabelecida essa relação:
1 g = 6 x 10^23 u
O mol é a unidade de grandeza usada para definir a quantidade de matéria em um sistema que contenha o mesmo número de unidades elementares quanto forem os átomos em 12 g de carbono-12. Vamos ver como isso funciona?
A quantidade de matéria é representada por "n".
Em uma amostra com 12 g de carbono, qual a quantidade de átomos presentes? Sabemos que 1 átomo de carbono tem uma massa de 12u. Também sabemos que 1 g = 6x10^23u. A partir disso, temos:
C = 12 x u
12 x 1 g = 12 x u x 6x10^23
12 x 1 g = 1 C x 6x10^23
12g = 6x10^23 C
Assim, 12 g de carbono contêm 6x10^23 átomos de carbono.
Constante de Avogadro
Há, em qualquer amostra, uma quantidade muito grande de quantidades. Assim, essas amostras possuem uma determinada quantidade de matéria, proporcional à massa. A Constante de Avogadro vem a ser, justamente, essa constante de proporcionalidade. Ela vale 6,02214 x 10^23 mol^-1. Ao contrário de outras constantes, como a gravitacional, por exemplo, a Constante de Avogadro é uma constante com unidade, não um número puro. Para efeitos de cálculo, muitas vezes o número é arredondado para 6 x 10^23.
Massa molar
Qualquer amostra de uma substância possui uma massa (m). Essa massa é diretamente proporcional à quantidade de matéria (n).
Matematicamente, essa relação pode ser expressa assim:
m = M . n
Em que M é uma constante de proporcionalidade. Mas não se apegue a isso, calcular a massa molar é mais simples do que parece.
A constante M é chamada de massa molar, que nada mais é do que a massa de determinada substância (g) por unidade de matéria (mol).
O que acontece quando substituímos u por g?
Isso é algo como falar em massa atômica e massa molar. A massa atômica do sódio é 23 u. A massa molar do sódio é 23 g/mol. O que muda? Apenas a unidade de medida?
Não. Quando dizemos que a massa atômica do sódio é 23 u, estamos dizendo que a massa de um átomo de sódio é igual a 23 vezes ½ do carbono-12. Quando dizemos que a massa molar do sódio é 23 g/mol, estamos dizendo que 6x10^23 átomos de sódio têm uma massa de 23 g.
Assim, podemos calcular a massa molar de um elemento e uma substância.
Como exemplo, temos o Al. Nesse caso, vamos considerar o alumínio uma substância metálica. Conforme a massa atômica da tabela periódica, sabemos que, em 1 unidade de quantidade de matéria, há 27 g de Al.
Para o NaCl, por exemplo, vamos calcular a massa de 1 mol de conjunto de íons. Assim, temos que (conforme consta na tabela periódica):
M (Na) = 23 g/mol
M (Cl) = 35,5 g/mol
Como a proporção de íons Na^+ e Cl^- é 1: 1, temos que um íon de Na se junta com um íon de Cl para formar a substância iônica NaCl. A massa molar do NaCl é, portanto, 58,5 g/mol.

Fórmulas químicas
Há várias formas de representar um composto químico. Por ora, veremos a fórmula molecular, a fórmula empírica (ou mínima) e a fórmula porcentual (ou centesimal),
- Fórmula molecular: indica quais são os átomos que formam uma substância e em que quantidade estão presentes.
Por exemplo, a fórmula molecular da água é H2O. O que isso indica? Que a água é formada por dois átomos de hidrogênio e um de oxigênio. A expressão "fórmula molecular" não é utilizada para fazer referências a substâncias iônicas e metálicas, pois estas não formam moléculas.
- Fórmula empírica (mínima): indica a proporção entre a quantidade de átomos de cada elemento de uma substância nos menores números possíveis.
Por exemplo, temos o peróxido de hidrogênio (H2O2), a água oxigenada. A partir disso, podemos ver que uma molécula de peróxido de hidrogênio é formada por dois átomos de hidrogênio e dois átomos de oxigênio. Logo, a proporção é 2:2. Esse número, quando dividido, fica um, ou seja, o menor número inteiro possível. Assim, a fórmula mínima do peróxido de hidrogênio é HO.
Algumas substâncias, como é o caso da água, possuem a fórmula mínima igual à fórmula molecular. Na água, a proporção e de 2 átomos de hidrogênio para 1 átomo de oxigênio, 2:1. Não há como fazer uma divisão de forma a chegar ao menor número inteiro possível. Então, a fórmula mínima da água é igual à sua fórmula molecular
- Fórmula centesimal (porcentual): indica a porcentagem em massa dos elementos que formam a substância.
Como calcular?
O primeiro passo é obter a massa molar do composto.
Ex: NaOH
M (Na) = 23 g/mol
M (O) = 16 g/mol
M (H) = 1 g/mol,
Logo: 23 + 16 + 1 = 40 g/mol
Agora que sabemos a massa molar do composto, sabemos que ela corresponde a 100% da massa da substância. Assim, qual a porcentagem de Na, O, e H, respectivamente?
Para o Na Para o O Para o H
40g ------------- 100% 40g ------------- 100% 40g ------------ 100%
23g ------------- x 16g --------------- x 1g -------------- x
x = 57,5% x= 40% x=2,5%
Logo, a fórmula centesimal é Na57,5%O40%H2,5%
Sabendo uma dessas fórmulas, podemos descobrir as outras.

Resumindo:
Texto por: Giovana Bagnara Luisi
Estudante de Química
Referência:
(TITO), Francisco Miragaia Peruzzo; CANTO, Eduardo Leite do. Química: na abordagem do cotidiano. 3. ed. São Paulo: Moderna, 2007. 760 p.
Crédito da imagem:
https://1.bp.blogspot.com/-E5JQnR3HYxY/XLjvq9B5elI/AAAAAAAALo8/upZ42NzCjfI4aS5jWnD0GCwp5zv92kaNgCLcBGAs/s1600/1-doze-avos-massa-atomica.gif
