Funções inorgânicas I: ácidos e bases
No início da Química, os ácidos eram identificados por seu sabor azedo, como, por exemplo, o vinagre. Já as bases ou álcalis, quando em soluções aquosas, eram reconhecidas pelo gosto de sabão. Mas hoje já conhecemos jeitos mais seguros de fazer esse reconhecimento, pelo uso de indicadores.
Até agora, vimos que os métodos para diferenciar essas duas funções não envolviam nenhum experimento ou teoria microscópica. Além disso, haviam substâncias como o cloreto de sódio e do etanol que não se encaixavam nessas definições.
Assim, alguns cientistas começaram a estudar o assunto. Cada um deles com a sua teoria. Não podemos dizer qual é certa, qual é errada, porque elas fazem sentido e, muitas vezes, se complementam. Arrhenius, Lewis, Brønsted e Lowry são os mais estudados.
Para
nosso estudo, usaremos a definição de ácido e base de Arrhenius.
Saiba mais: teorias de ácidos e bases.
Ácidos:
Para Arrhenius, um ácido é um composto que contém hidrogênio e reage com a água para liberar um íon hidrogênio. Em resumo, é aquela substância que "solta" um H^+, como um único cátion, sendo que o ânion varia.
Um exemplo: HCl. Quando em contato com a água, o ácido clorídrico libera o cátion H^+ e um ânion Cl^-.
Os ácidos podem ser divididos entre os hidrácidos (não oxigenados) e os oxiácidos (oxigenados).
Nomenclatura dos hidrácidos:
Essa nomenclatura é bem simples. Primeiro, é importante saber reconhecer esses ácidos: se houver um cátion H^+ e um ânion diferente de OH^-, é um hidrácido.
Ácido + nome do elemento + ídrico
Para
nomear, é simples: basta escrever o nome do elemento com a terminação -ídrico. Alguns exemplos:
- HCl -> ácido clorídrico
- HI -> ácido iodídrico
- HBr -> ácido bromídrico
- HCN -> ácido cianídrico
- H2S -> ácido sulfídrico
É necessário prestar atenção aos elementos: alguns tem seu nome em latim empregado no ácido (sulfur, enxofre). Podemos também nos encontrar com íons compostos (CN^-, íon cianeto).
Nomenclatura dos oxiácidos:
Essa nomenclatura é mais complicada de ser feita (mas não impossível!). Esses ácidos se diferenciação pela presença do oxigênio. Aqui teremos que usar a chamada regra do NOX (número de oxidação).
Ácido + nome do elemento central + oso/ico, conforme o NOX.
Observe a tabela:
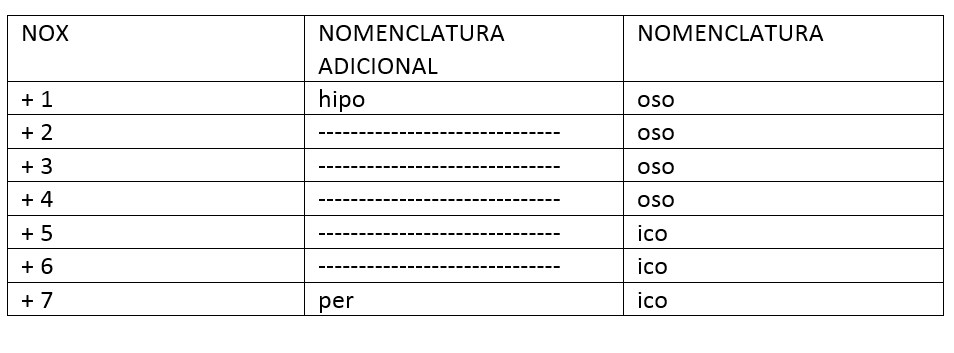
Para decorar que é "oso" e quem é "ico", fica a dica: menoroso e maiorico. Parecem estúpidos, mas esses macetes realmente ajudam, principalmente em provas.
Há seis oxiácidos que você deve
saber. Não se preocupe em decorar agora, de tanto usar, você vai saber eles de
cor. Para ajudar, vai um macete: lembre-se do POCOSONOBOXO.

Aqui, temos exceções, no caso do carbono, do nitrogênio e do boro. Observe como esses nomes sofreram alterações:
O correto é carbônico, ao invés de "carbonoso". O correto é nitroso, ao invés de "nitrogenioso". O correto é bórico, ao invés de "boroso". Fique atento para esses casos.
Saiba mais: nomenclatura é tudo a mesma coisa. Será?
Classificação dos ácidos:
As maneiras para classifica-los são várias. A que mais utilizamos são a classificação pelo número de hidrogênio ionizável, pelo grau de ionização, pela volatilidade e pela solubilidade.
- Número de hidrogênios ionizáveis:
Podem ser monoácidos (com um H ionizável, por exemplo, o HCl), diácidos (H2S, H2SO4), triácidos (H3PO4) e tetrácidos (H4P2O7). Cuidado com as exceções: H3PO3, ácido fosforoso, é um diácido, pois apenas 2 H são ionizáveis. O mesmo vale para o H3PO2, ácido hipofosforoso, que apresenta apenas 1 H ionizável.
Saiba mais: por que os ácidos fosforoso e hipofosforoso não têm 3 H ionizáveis?
- Grau de ionização:
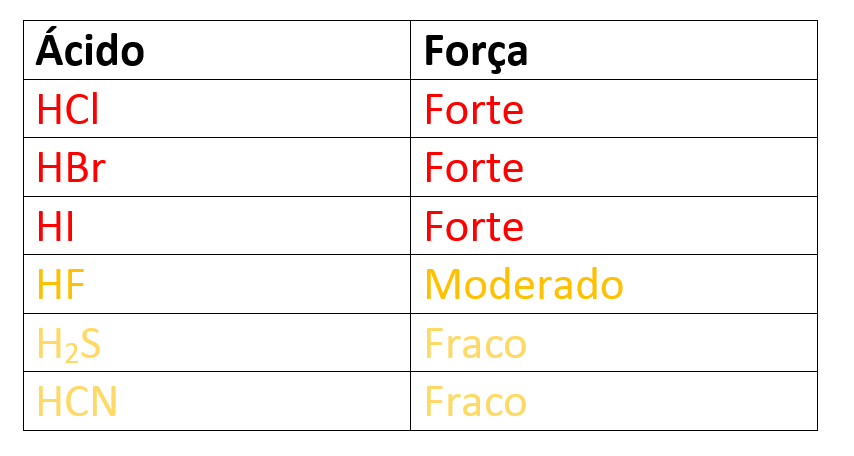
Essa é a classificação mais utilizada para falarmos nos ácidos fortes e fracos. O grau de ionização mede a relação entre o número de moléculas dissolvidas e o número de moléculas ionizadas, tal que:
α= moléculas ionizadas/moléculas dissolvidas
É um número medido em porcentagem, por exemplo, α = 0,92%. Para um resultado assim, podemos interpretar que, se tivéssemos 100 moléculas de HCl, todas seriam dissolvidas, mas apenas 92 seriam ionizadas. Assim, ácidos:
- Fortes, quando α for maior ou igual a 50%.
- Moderados, quando α for menor que 50% e maior que 5%.
- Fracos, quando α for menor que 5%.
Mas e
se não tivermos esses dados? Como fazemos? Para os hidrácidos, não há jeito.
Como já foi dito, o uso frequente acaba por tornar essas classificações
automáticas após um tempo.
Para os oxiácidos, é regra é mais simples. Observe o número de oxigênios. Agora, observe o número de H ionizáveis. Faça x = O - H. E aí está a classificação.
Se o resultado dessa subtração for 0, o ácido é fraco. Exemplo: ácido bórico, H3BO3.
Se o resultado dessa subtração for 1, o ácido é moderado. Exemplo: ácido carbônico, H3CO2.
Se o resultado dessa subtração for 2 ou 3, é melhor tirar toda matéria orgânica de perto, pois é um ácido forte. Exemplos: ácido sulfúrico, H2SO4, e ácido perbrômico, HBrO4.
Saiba mais: POCOSONOBOXO: onde são usados esses ácidos?
- Volatilidade:
Essa classificação é baseada na capacidade das substâncias de passar do estado líquido para o gasoso. O que consideramos, nesse estudo e nessa classificação, é a velocidade com que esse processo acontece. Assim, temos os ácidos fixos, que são o H2SO4 e o H3PO3, e os voláteis, que são, bem, todo o resto.
- Solubilidade:
A maioria dos ácidos são solúveis em água.
Saiba mais: existem ácidos insolúveis?
Ionização dos ácidos
Sabemos que ácidos são compostos iônicos, que ligam um ametal ao hidrogênio. Da mesma forma que essa ligação acontece, ela pode ser quebrada. Por exemplo:
H^+ + Cl^- -> HCl
HCl -> H^+ + Cl^-
Isso pode acontecer, ainda, em etapas, então teremos uma ionização parcial:
H2SO4 -> H^+ HSO4
Quando, se fosse total, seria:
H2SO4 -> 2 H^+ + SO4^-
Bases:
Para Arrhenius, uma base é um composto que produz um íon hidroxila (OH^-). Em resumo, é uma substância que "solta" OH^- como único ânion, sendo que o cátion varia.
Um exemplo: NaOH. Quando em contato com a água, o hidróxido de sódio libera o cátion Na^+ e o ânion OH^-.
As bases podem ser dividas de acordo com a carga do cátion: carga fixa e carga variável.
Bases de metais com carga fixa
É uma nomenclatura mais simples do que a dos ácidos:
Hidróxido de + nome do elemento/cátion.
Os elementos de carga fixa são:

As duas famílias são fáceis de lembrar. Mas esses três... Se liga nisso: PRAZINAL 123, prata, zinco, alumínio, 1, 2, 3.
Bases de metais de carga variável:
O princípio é o mesmo:
Hidróxido de + nome do elemento/cátion.
Aqui estão os principais cátions de carga variável. Lembra do menoroso e maiorico? Vamos usar aqui também.
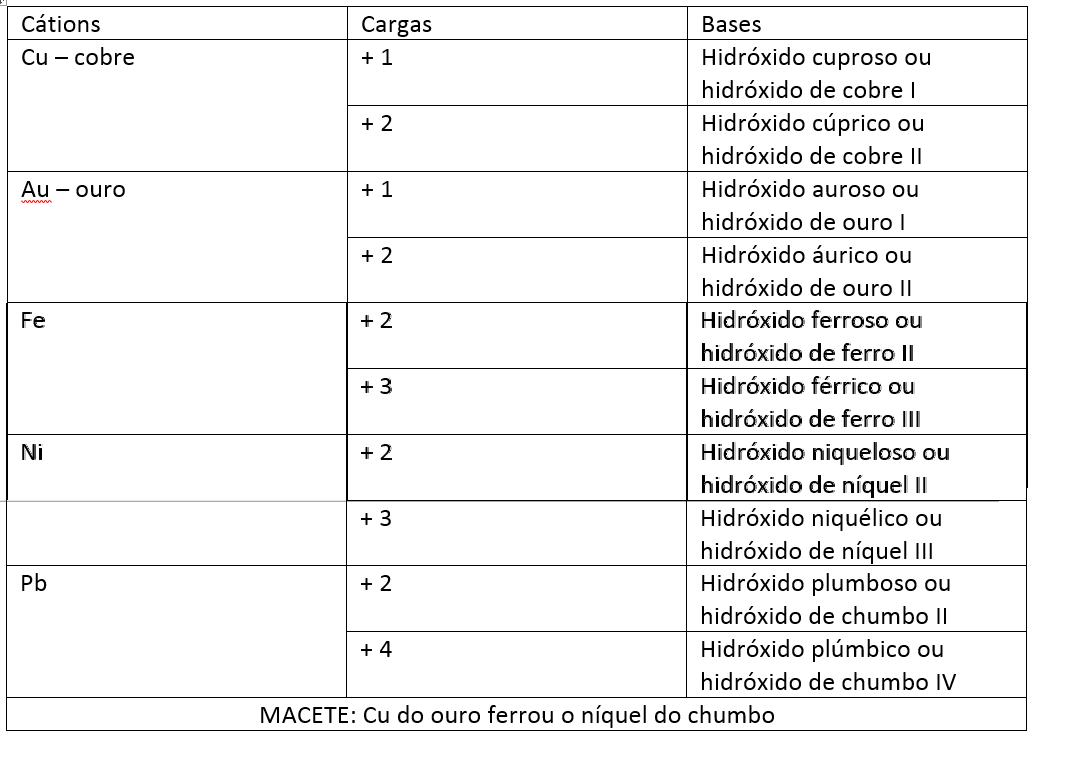
Essa terminação é utilizada para cátions que têm apenas 2 cargas possíveis.
É importante considerar que as bases são compostos iônicos. Há uma ligação covalente entre o oxigênio e o hidrogênio para formar o ânion hidroxila (OH^-), mas o caráter da ligação que prevalece é o caráter iônico.
Todas as bases são formadas por um metal (cátion) e a hidroxila, certo? Errado. A disciplina de Química é, também, onde você aprende a escrever corretamente a palavra exceção. Brincadeiras à parte, a única base que não possui um metal é o tal do hidróxido de amônio, NH4OH.
Classificação das bases:
Essa classificação, também, pode se dar de diversas maneiras. Veremos as principais:
- Número de hidroxilas
Monobases: NaOH, KOH, NH4OH
Dibases: Ca(OH)2, Mg(OH)2
Tribases: Al(OH)3, Au(OH)3, Fe(OH)3
Tetrabases: Pb(OH)4, Sn(OH)4
- Solubilidade
O cátion ligado à hidroxila influencia bastante na hora de testarmos a solubilidade de uma base. Assim, temos:
Bases muito solúveis: são as bases formadas por metais alcalinos. E o hidróxido de amônio, não vamos esquecer.
Bases pouco solúveis: são as bases formadas pelos metais alcalino-terrosos. Nesse grupo, há uma exceção: o hidróxido de magnésio, Mg(OH)2.
Bases praticamente insolúveis: todo o resto. Inclusive o Mg(OH)2.
- Grau de dissociação:
A solubilidade e a força de uma base estão muito ligadas. Quanto maior a solubilidade, maior o grau de dissociação, portanto, maior a força da base. Assim, temos as bases fracas e as bases fortes.
Bases fortes: bases de metais alcalinos e alcalino-terrosos. Exceto o hidróxido de magnésio. E o hidróxido de berílio. Pode-se até dizer "beba magnésio" como macete. Mas não façam isso.
Bases fracas: todo o resto, inclusive o hidróxido de amônio.
A título de conhecimento, o hidróxido de amônio é a única base solúvel e fraca.
Texto por: Giovana Bagnara Luisi
Estudante de Química
Referência:
(TITO), Francisco Miragaia Peruzzo; CANTO, Eduardo Leite do. Química: na abordagem do cotidiano. 3. ed. São Paulo: Moderna, 2007. 760 p.
